ųĖ╩Šä®╩Ū╗»īW(xu©”)įćä®ųąĄ─ę╗ŅÉĪŻį┌ę╗Č©Įķ┘|(zh©¼)Śl╝■Ž┬Ż¼ŲõŅü╔½─▄░l(f©Ī)╔·ūā╗»Īó─▄«a(ch©Żn)╔·£åØß╗“│┴ĄĒŻ¼ęį╝░ėą¤╔╣Ō¼F(xi©żn)Ž¾Ą╚ĪŻ│Żė├╦³Öz“×(y©żn)╚▄ę║Ą─╦ßēAąįŻ╗Ą╬Č©Ęų╬÷ųąė├üĒųĖ╩ŠĄ╬Č©ĮK³c(di©Żn)Ż╗Łh(hu©ón)Š│Öz£y(c©©)ųąÖz“×(y©żn)ėą║”╬’ĪŻę╗░ŃĘų×ķ╦ßēAųĖ╩Šä®Īóč§╗»▀ĆįŁųĖ╩Šä®ĪóĮī┘ųĖ╩Šä®Īó╬³ĖĮųĖ╩Šä®Ą╚ĪŻųĖ╩Šä®ĘųŅÉ 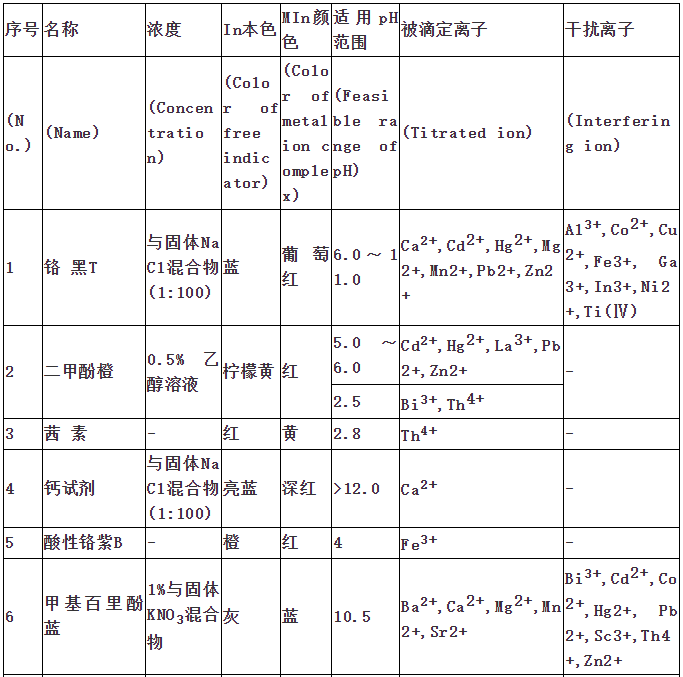
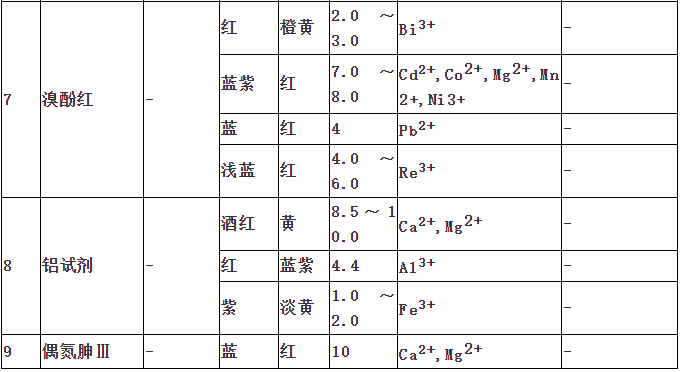
ųĖ╩Šä®ū„ė├įŁ└Ē ųĖ╩Šä®Ą─ė├┴┐å¢Ņ}
1Īó╦ßēAųĖ╩Šä®
ųĖ╩Š╚▄ę║ųąH+ØŌČ╚Ą─ūā╗»Ż¼╩Ūę╗ĘNėąÖC(j©®)╚§╦ß╗“ėąÖC(j©®)╚§ēAŻ¼Ųõ╦ßąį║═ēAąįŠ▀ėą▓╗═¼Ą─Ņü╔½ĪŻ
ęį╝ū╗∙│╚(Ka=10-3.4)×ķ└²Ż¼╚▄ę║Ą─pH<3.1Ģr(sh©¬)Ż¼│╩╦ßąįŻ¼Š▀╝t╔½;ph>4.4Ģr(sh©¬)Ż¼│╩ēAąįŻ¼Š▀³S╔½Ż╗Č°į┌pH3.1~4.4Ż¼ät│÷¼F(xi©żn)╝t³SĄ─╗ņ║Ž╔½│╚╔½Ż¼ĘQų«×ķųĖ╩Šä®Ą─ūā╔½ĘČć·ĪŻ▓╗═¼Ą─╦ßēAųĖ╩Šä®ėą▓╗═¼Ą─ūā╔½ĘČć·ĪŻ
2Īó╗ņ║Ž╦ßēAųĖ╩Šä®
ūóŻ║╗ņ║Ž╦ßēAųĖ╩Šä®ę¬▒Ż┤µį┌╔Ņ╔½Ų┐ųąĪŻ
3Īóč§╗»▀ĆįŁųĖ╩Šä®
č§╗»▀ĆįŁųĖ╩Šä®ė├ė┌č§╗»▀ĆįŁĘ©╚▌┴┐Ęų╬÷ĪŻŽ┬▒Ē┴ą│÷ę╗ą®į┌Į╠īW(xu©”)║═╣żū„ųąĮø(j©®ng)│Ż╩╣ė├Ą─▓┐Ęųč§╗»▀ĆįŁųĖ╩Šä®ĪŻ
4ĪóĮj(lu©░)║ŽųĖ╩Šä®
į┌Įj(lu©░)║ŽĄ╬Č©ųąŻ¼═©│ŻČ╝╩Ū└¹ė├ę╗ĘN─▄┼cĮī┘ļxūė╔·│╔ėą╔½┼õ║Ž╬’Ą─’@╔½ä®üĒųĖ╩ŠĄ╬Č©▀^│╠ųąĮī┘ļxūėØŌČ╚Ą─ūā╗»Ż¼┤╦ĘN’@╔½ä®ĘQ×ķĮī┘ļxūėųĖ╩Šä®Ż¼╝┤Įj(lu©░)║ŽųĖ╩Šä®ĪŻ
5Īó╬³ĖĮųĖ╩Šä®
╬³ĖĮųĖ╩Šä®ī”(du©¼)Ą╬Č©Śl╝■Ą─ę¬Ū¾Ż║ųĖ╩Šä®Ą─╬³ĖĮ─▄┴”╚§ė┌┤²£y(c©©)ļxūėĪŻ
╬³ĖĮųĖ╩Šä®╩Ūę╗ŅÉėąÖC(j©®)╚Š┴ŽŻ¼ė├ė┌│┴ĄĒĘ©Ą╬Č©ĪŻ«ö(d©Īng)╦³▒╗╬³ĖĮį┌─z┴Ż▒Ē├µ║¾Ż¼┐╔─▄╩Ūė╔ė┌ą╬│╔┴╦─│ĘN╗»║Ž╬’Č°ī¦(d©Żo)ų┬ųĖ╩Šä®ĘųūėĮY(ji©”)śŗ(g©░u)Ą─ūā╗»Ż¼Å─Č°ę²ŲŅü╔½Ą─ūā╗»ĪŻį┌│┴ĄĒĄ╬Č©ųąŻ¼┐╔ęį└¹ė├╦³Ą─┤╦ĘNąį┘|(zh©¼)üĒųĖ╩ŠĄ╬Č©Ą─ĮK³c(di©Żn)ĪŻ
╬³ĖĮųĖ╩Šä®┐╔Ęų×ķā╔┤¾ŅÉŻ║ę╗ŅÉ╩Ū╦ßąį╚Š┴ŽŻ¼╚ń¤╔╣Ō³S╝░Ųõč▄╔·╬’Ż¼╦³éā╩ŪėąÖC(j©®)╚§╦߯¼─▄ĮŌļx│÷ųĖ╩Šä®ĻÄļxūėŻ╗┴Ēę╗ŅÉ╩ŪēAąį╚Š┴ŽŻ¼╚ń╝ū╗∙ūŽĄ╚Ż¼╦³éā╩ŪėąÖC(j©®)╚§ēAŻ¼─▄ĮŌļx│÷ųĖ╩Šä®Ļ¢ļxūėĪŻ
6Īó¤╔╣ŌųĖ╩Šä®
Ą╬Č©║═┤_Č©£åØßę║¾w║═ėą╔½ę║¾wĄ─pH┐╔ęį╩╣ė├¤╔╣ŌųĖ╩Šä®ĪŻį┌Ą╬Č©▀^│╠ųą¤╔╣Ō╔½ūā▓╗╩▄ę║¾wŅü╔½║═Ųõ═Ė├„Č╚Ą─ė░ĒæŻ¼ę“┤╦│Ż▒╗▀xė├ĪŻ
į┌īŹ(sh©¬)ļH╣żū„ųąŻ¼╚Ōč█╩Ūļyęį£╩(zh©│n)┤_Ąžė^▓ņ│÷ųĖ╩Šä®ūā╔½³c(di©Żn)Ņü╔½Ą─╬óąĪĄ─Ė─ūāĪŻ╚╦éā─┐£y(c©©)╦ßēAųĖ╩Šä®Å─ę╗ĘNŅü╔½ūā?y©Łu)ķ┴Ēę╗ĘNŅü╔½Ą─▀^│╠Ż¼ų╗─▄į┌ę╗Č©Ą─pHūā╗»ĘČć·ā╚(n©©i)▓┼─▄░l(f©Ī)╔·Ż¼╝┤ų╗ėą«ö(d©Īng)ę╗ĘNŅü╔½ŽÓ«ö(d©Īng)ė┌┴Ēę╗ĘNŅü╔½ØŌČ╚Ą─╩«▒ČĢr(sh©¬)▓┼─▄├ŃÅŖ(qi©óng)▒µšJ(r©©n)ŲõŅü╔½Ą─ūā╗»ĪŻį┌▀@ĘNŅü╔½ūā╗»Ą─═¼Ģr(sh©¬)Ż¼Įķ┘|(zh©¼)Üõ£ńŠ·╔·╬’ųĖ╩Šä®Ą─pHųĄätė╔ę╗éĆ(g©©)ųĄūāĄĮ┴Ēę╗éĆ(g©©)ųĄĪŻ
╚▄ę║Ą─Ņü╔½ūā╗»ĘČć·ĘQ×ķųĖ╩Šä®Ą─ūā╔½ĘČć·╝┤ūā╔½ė“ĪŻį┌ūā╔½ĘČć·ā╚(n©©i)Ż¼«ö(d©Īng)╚▄ę║Ą─pHųĄĖ─ūāĢr(sh©¬)Ż¼ēA╔½│╔Ęų║═╦ß╔½│╔ĘųĄ─▒╚ųĄļSų«Ė─ūāŻ¼ųĖ╩Šä®Ą─Ņü╔½ę▓░l(f©Ī)╔·Ė─ūāĪŻųĖ╩Šä®Ą─ūā╔½ĘČć·╝s2éĆ(g©©)pHå╬╬╗ĪŻė╔ė┌╚╦Ą─ęĢėXī”(du©¼)Ė„ĘNŅü╔½Ą─├¶Ėą│╠Č╚▓╗═¼Ż¼╝ė╔Žį┌ūā╔½ė“ā╚(n©©i)ųĖ╩Šä®│╩¼F(xi©żn)╗ņ║Ž╔½Ż¼ā╔ĘNŅü╔½╗źŽÓė░Ēæė^▓ņŻ¼╦∙ęįīŹ(sh©¬)ļHė^▓ņĮY(ji©”)╣¹┼c└ĒšōųĄėą▓ŅäeŻ¼┤¾ČÓöĄ(sh©┤)ųĖ╩Šä®Ą─ūā╔½ĘČć·ąĪė┌2éĆ(g©©)pHå╬╬╗ĪŻ
ļp╔½ųĖ╩Šä®Ą─ūā╔½ĘČć·▓╗╩▄Ųõė├┴┐Ą─ė░ĒæŻ¼Ą½ę“ųĖ╩Šä®▒Š╔ĒŠ═╩Ū╦ß╗“ēAŻ¼ųĖ╩Šä®Ą─ūā╔½ę¬Ž¹║─ę╗Č©Ą─Ą╬ȩ䮯¼Å─Č°į÷┤¾£y(c©©)Č©Ą─š`▓ŅĪŻī”(du©¼)ė┌å╬╔½ųĖ╩Šä®Č°čįŻ¼ė├┴┐▀^ČÓŻ¼Ģ■(hu©¼)╩╣ė├ūā╔½ĘČć·Ž“pHųĄ£pąĪĄ─ĘĮŽ“░l(f©Ī)╔·ęŲäė(d©░ng)Ż¼ę▓Ģ■(hu©¼)į÷┤¾Ą╬Č©Ą─š`▓ŅĪŻ└²╚ń:ė├0.1mol/LNaOHĄ╬Č©0.1mol/LHAcŻ¼pHsp=8.5,═╗▄SĘČć·×ķpH8.70-9.00Ż¼Ą╬Č©¾wĘe╚¶×ķ50mLŻ¼Ą╬╚ļ2~3Ą╬Ęė╠¬Ż¼┤¾╝sį┌pH=9Ģr(sh©¬)│÷¼F(xi©żn)╝t╔½Ż╗╚¶Ą╬╚ļ10~15Ą╬Ęė╠¬Ż¼ätį┌pH=8Ģr(sh©¬)│÷¼F(xi©żn)╝t╔½ĪŻ’@╚╗║¾š▀Ą─Ą╬Č©š`▓Ņę¬┤¾Ą├ČÓĪŻ
ųĖ╩Šä®ė├┴┐▀^ČÓŻ¼▀ĆĢ■(hu©¼)ė░Ēæūā╔½Ą─├¶õJąįĪŻ└²╚ńŻ║ęį╝ū╗∙│╚×ķųĖ╩Šä®Ż¼ė├HClĄ╬Č©NaOH╚▄ę║Ż¼ĮK³c(di©Żn)×ķ│╚╔½Ż¼╚¶╝ū╗∙│╚ė├┴┐▀^ČÓätĮK³c(di©Żn)├¶õJąįŠ═▌^▓ŅĪŻ
│Żė├ųĖ╩Šä®Ą─┼õųŲŻ©╣®ģó┐╝Ż®
(Š▀¾w┼õųŲĘĮĘ©ęįīŹ(sh©¬)“×(y©żn)ś╦(bi©Īo)£╩(zh©│n)×ķ£╩(zh©│n))
1ĪóČ■▒Į░Ę╗Ū╦ßŌcųĖ╩Šę║Ż║
2ĪóČ■▒Į┘╔ļ┬ųĖ╩Šę║Ż║
╚ĪČ■▒Į┘╔ļ┬1gŻ¼╝ėęę┤╝100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
╚Īļp┴“ļĻ50mgŻ¼╝ėęę┤╝100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
4Īó╩»╚’ųĖ╩Šę║Ż║
╚Ī╩»╚’Ę█─®10g,╝ėęę┤╝40mLŻ¼╗ž┴„ų¾Ęą1ąĪĢr(sh©¬),ņoų├Ż¼āA╚ź╔ŽīėŪÕę║Ż¼į┘ė├═¼ę╗ĘĮĘ©╠Ä└ĒČ■┤╬Ż¼├┐┤╬ė├ęę┤╝30mLŻ¼Üł?ji©Īn)³ė├╦?0mLŽ┤£ņŻ¼āA╚źŽ┤ę║Ż¼į┘╝ė╦«50mLŻ¼ų¾ĘąŻ¼Ę┼└õŻ¼×V▀^Ż¼╝┤Ą├ĪŻūā╔½ĘČć·pH4.5~8.0(╝tĪ·╦{(l©ón))ĪŻ
5Īó╝ūĘė╝tųĖ╩Šę║Ż║
╚Ī╝ūĘė╝t0.1gŻ¼╝ė0.05mol/LÜõč§╗»Ōc╚▄ę║5.3ml╩╣╚▄ĮŌŻ¼į┘╝ė╦«ŽĪßīų┴100mLŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH7.2~8.8(³SĪ·╝t)
6Īó╝ūĘė╝t-„ĻŽŃ▓▌Ęė╦{(l©ón)╗ņ║ŽųĖ╩Šę║Ż║
╚Ī╝ūĘė╝tųĖ╩Šę║1Ę▌┼c0.1%„ĻŽŃ▓▌Ęė╦{(l©ón)╚▄ę║3Ę▌,╗ņ║ŽŻ¼╝┤Ą├ĪŻ
╝ū╗∙╝tųĖ╩Šę║╚Ī╝ū╗∙╝t0.1gŻ¼╝ė0.05mol/LÜõč§╗»Ōc╚▄ę║7.4mL╩╣╚▄ĮŌŻ¼į┘╝ė╦«ŽĪßīų┴200mLŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH4.2~6.3(╝tĪ·³S)ĪŻ
7Īó1g/L(0.1%) ╝ū╗∙╝tųĖ╩Šä®Ą─┼õųŲĘĮĘ©
╦∙ąĶ╦ÄŲĘŻ║╝ū╗∙╝tĪŻ
ė├═ŠŻ║┼õųŲ╝ū╗∙╝t-õÕ╝ūĘėŠG╗ņ║ŽųĖ╩Šä®ĪŻ
┼õųŲĘĮĘ©Ż║ĘQ╚Ī1g╝ū╗∙╝tŻ¼ė├1000mL¤o╦«ęę┤╝╚▄ĮŌĪŻ
8Īó╝ū╗∙╝t-üå╝ū╦{(l©ón)╗ņ║ŽųĖ╩Šę║Ż║
╚Ī0.1%╝ū╗∙╝tĄ─ęę┤╝╚▄ę║20mLŻ¼╝ė0.2%üå╝ū╦{(l©ón)╚▄ę║8mLŻ¼ōuä“Ż¼╝┤Ą├ĪŻ
9Īó╝ū╗∙╝t-õÕ╝ūĘėŠG╗ņ║ŽųĖ╩Šę║Ż║
╚Ī0.1%╝ū╗∙╝tĄ─ęę┤╝╚▄ę║20mLŻ¼╝ė0.2%õÕ╝ūĘėŠGĄ─ęę┤╝╚▄ę║30mLŻ¼ōuä“Ż¼╝┤Ą├ĪŻ
10Īó0.1%(1g/L)╝ū╗∙│╚ųĖ╩Šę║Ż║
╚Ī╝ū╗∙│╚0.1gŻ¼╝ė╦«100mL╩╣╚▄ĮŌŻ¼¤ß╚▄ĮŌŻ¼└õģs║¾▀^×Véõė├ĪŻūā╔½ĘČć· pH3.2~4.4(╝tĪ·³S)ĪŻ
šf├„Ż║├┐100 mLĄ╬Č©ę║╝ė1Ą╬ĪŻ╝ėĄ─┴┐╠½ČÓŻ¼Ę┤Č°▓╗├„┤_ĪŻ▒ŠųĖ╩Šę║▀mė├ė┌╚§ēA╗“░▒ĪóÜõč§╗»Ō}ĪóÜõč§╗»µJĪóÜõč§╗»õ^ĪóÜõč§╗»µVĄ─Ą╬Č©Ż¼▓╗▀mė├ė┌╚§╦߯¼└²╚ńÜõŪĶ╦ßĪó╠╝╦ßĪóüå╔ķ╦ßĪó┼╦ßĪóŃt╦ßĪóėąÖC(j©®)╦ߥ─Ą╬Č©Ż¼ę“┤╦Ą╬Č©ÅŖ(qi©óng)╦ßĢr(sh©¬)Ż¼▀@ą®╦ß╣▓┤µ╩Ūø]ėąė░ĒæĄ─ĪŻŽ§╦ß─▄ŲŲē─╝ū╗∙│╚Ż¼╣╩▓╗▀mė├Ż¼Ą½┐╔╝ė╚ļ▀^┴┐Ą─ēAį┘▀M(j©¼n)ąąĄ╬Č©ĪŻ╝ū╗∙│╚ę▓ė├ė┌ęę┤╝╚▄ę║Ą─Ą╬Č©ĪŻ
11Īó╝ū╗∙│╚-Č■╝ū▒Į╦{(l©ón)FF╗ņ║ŽųĖ╩Šę║Ż║
╚Ī╝ū╗∙│╚┼cČ■╝ū▒Į╦{(l©ón)FFĖ„0.1gŻ¼╝ėęę┤╝100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
12ĪóÓÅČ■Ą¬ĘŲųĖ╩Šę║Ż║
╚Ī┴“╦ßüåĶF0.5gŻ¼╝ė╦«100mL╩╣╚▄ĮŌ,╝ė┴“╦ß2Ą╬┼cÓÅČ■Ą¬ĘŲ0.5g,ōuä“Ż¼╝┤Ą├ĪŻ▒Šę║æ¬(y©®ng)┼Rė├ą┬ųŲĪŻ
13Īó▄ń╦ž╗Ū╦ßŌcųĖ╩Šę║Ż║
╚Ī▄ń╦ž╗Ū╦ßŌc0.1gŻ¼╝ė╦«100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH3.7~5.2(³SĪ·ūŽ)
14Īó¤╔╣Ō³SųĖ╩Šę║Ż║
╚Ī¤╔╣Ō³S0.1gŻ¼╝ėęę┤╝100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
15ĪóŌ}³SŠG╦žųĖ╩Šä®Ż║
╚ĪŌ}³SŠG╦ž0.1gŻ¼╝ė┬╚╗»Ōø10gŻ¼čą─źŠ∙ä“Ż¼╝┤Ą├ĪŻ
16ĪóŌ}ūŽ╝t╦žųĖ╩Šä®Ż║
╚ĪŌ}ūŽ╝t╦ž0.1gŻ¼╝ė¤o╦«┴“╦ßŌc10g,čą─źŠ∙ä“Ż¼╝┤Ą├ĪŻ
17ĪóĮ¬³SųĖ╩Šę║Ż║
╚ĪĮ¬³SĘ█─®20gŻ¼ė├└õ╦«Į■Øn4┤╬Ż¼├┐┤╬100mL,│²╚ź╦«╚▄ąį╬’┘|(zh©¼)║¾Ż¼Üł?ji©Īn)³į?00ĪµĖ╔į’Ż¼╝ėęę┤╝100mLŻ¼Į■ØnöĄ(sh©┤)╚šŻ¼×V▀^Ż¼╝┤Ą├ĪŻ
18ĪóĮY(ji©”)Š¦ūŽųĖ╩Šę║Ż║
╚ĪĮY(ji©”)Š¦ūŽ0.5gŻ¼╝ė▒∙┤ū╦ß100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
19ĪóĘė╠¬ųĖ╩Šę║Ż║
0.1%Ż©1g/LŻ®Ęė╠¬ųĖ╩Šä®Ą─┼õųŲĘĮĘ©
0.1% Ą─Ęė╠¬ųĖ╩Šä®╩ŪųĖ100mL╚▄ę║╩╣ė├ 0.1g Ą─Ęė╠¬ĪŻ
┼õų├ĘĮĘ©Ż║ĘQ┴┐ 0.1g Ęė╠¬Ż¼╚╗║¾ė├╔┘┴┐95%ęę┤╝╗“š▀¤o╦«ęę┤╝╚▄ĮŌŻ¼Č©┴┐▐D(zhu©Żn)ęŲų┴100mL╚▌┴┐Ų┐║¾į┘ė├ęę┤╝Č©╚▌ŽĪßīĄĮ100mL╝┤┐╔ĪŻ
0.5%Ż©5g/LŻ®Ęė╠¬ųĖ╩Šä®Ą─┼õųŲĘĮĘ©
╚Ī 0.5g Ęė╠¬Ż¼╚▄ė┌ęę┤╝Ż¼ė├ęę┤╝ŽĪßīų┴ 100mLŻ¼¤oąĶ╝ė╦«ĪŻūā╔½ĘČć· pH8.3Ī½10.0Ż©¤o╔½Ī·╝tŻ®ĪŻ
šf├„Ż║▒ŠųĖ╩Šę║ī”(du©¼)╦ß├¶ĖąŻ¼└²╚ńŻ¼ī”(du©¼)╠╝╦ßūā╔½Ż¼┐╔ė├üĒÖz▓ķ╩Ūʱ║¼╠╝╦ßÜŌĪŻ▀mė├ė┌ÅŖ(qi©óng)ēAĄ╬Č©¤oÖC(j©®)╦ßĪóėąÖC(j©®)╚§╦߯¼ę▓▀mė├ė┌ęę┤╝╚▄ę║Ą─Ą╬Č©ĪŻÅŖ(qi©óng)╦ߥ╬Č©╚§ēA(└²╚ń░▒)▓╗▀m║ŽĪŻ╣Ķ╦ß║═õX┤µį┌Ż¼ī”(du©¼)▒Š╚▄ę║ūā╔½¤oĘ┴ĄKĪŻ┼cØŌēAĮėė|╝t╔½Ž¹╩¦ĪŻ
20ĪóŃt║┌TųĖ╩Šä®(5g/L)Ą─┼õųŲĘĮĘ©
ĘQ╚Ī0.50gŃt║┌T║═4.5g┬╚╗»┴u░ĘŻ¼╚▄ė┌ęę┤╝ųąŻ¼ė├ęę┤╝ŽĪßīų┴100mLŻ¼┘A┤µė┌ūž╔½Ų┐ųąĪŻ┐╔▒Ż│ų?j©½n)?sh©┤)į┬▓╗ūā┘|(zh©¼)ĪŻ
21Īó5g /LĄĒĘ█ųĖ╩Šę║Ż║
╚Ī┐╔╚▄ąįĄĒĘ█0.5gŻ¼╝ė╦«5mLöćä“║¾Ż¼ŠÅŠÅāA╚ļ100mLĘą╦«ųąŻ¼ļS╝ėļSöć░ĶŻ¼└^└m(x©┤)ų¾Ęą2ĘųńŖŻ¼Ę┼└õŻ¼āA╚Ī╔ŽīėŪÕę║Ż¼╝┤Ą├ĪŻ▒Šę║æ¬(y©®ng)┼Rė├ą┬ųŲĪŻ
22ĪóĄŌ╗»ŌøĄĒĘ█ųĖ╩Šä®Ą─┼õųŲĘĮĘ©
╚ĪĄŌ╗»Ōø 0.2g Ż¼╝ėą┬ųŲĄ─ĄĒĘ█ųĖ╩Šę║100mL╩╣╚▄ĮŌĪŻ
23Īó┴“╦ßĶFõ@ųĖ╩Šę║Ż║
╚Ī┴“╦ßĶFõ@8gŻ¼╝ė╦«100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻ
24ĪóõÕĘė╦{(l©ón)ųĖ╩Šę║Ż║
╚ĪõÕĘė╦{(l©ón)0.1gŻ¼╝ė0.05mol/LÜõč§╗»Ōc╚▄ę║3.0mL╩╣╚▄ĮŌŻ¼į┘╝ė╦«ŽĪßīų┴200mLŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH2.8~4.6(³SĪ·╦{(l©ón)ŠG)ĪŻ
25ĪóõÕ„ĻŽŃ▓▌Ęė╦{(l©ón)ųĖ╩Šę║Ż║
╚ĪõÕ„ĻŽŃ▓▌Ęė╦{(l©ón)0.1gŻ¼╝ė0.05mol/LÜõč§╗»Ōc╚▄ę║3.2mL╩╣╚▄ĮŌŻ¼į┘╝ė╦«ŽĪßīų┴200mLŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH6.0~7.6(³SĪ·╦{(l©ón))ĪŻ
26Īó„ĻŽŃ▓▌Ęė╠¬ųĖ╩Šę║Ż║
╚Ī„ĻŽŃ▓▌Ęė╦{(l©ón)0.1gŻ¼╝ė0.05mol/LÜõč§╗»Ōc╚▄ę║4.3mL╩╣╚▄ĮŌŻ¼į┘╝ė╦«ŽĪßīų┴200mLŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH1.2~2.8(╝tĪ·³S)Ż╗pH8.0~9.6(³SĪ·ūŽ╦{(l©ón))ĪŻ
╚Ī„ĻŽŃ▓▌Ęė╠¬0.1gŻ¼╝ėęę┤╝100mL╩╣╚▄ĮŌŻ¼╝┤Ą├ĪŻūā╔½ĘČć· pH9.3~10.5(¤o╔½Ī·╦{(l©ón))ĪŻ
27Īó„ĻŽŃ▓▌Ęė╦{(l©ón)ųĖ╩Šę║Ż║
 ╩ųÖC(j©®)░µ
╩ųÖC(j©®)░µ





